728x90
반응형
SMALL
2025년 7월 23일 발효되는 ICH E6(R3) 임상시험 가이드라인의 주요 변경 사항, 시행 일정, 한국의 대응 현황, 그리고 CRA와 연구자에게 미치는 영향을 상세히 분석합니다.

1. 📂 구조의 전면 재편성
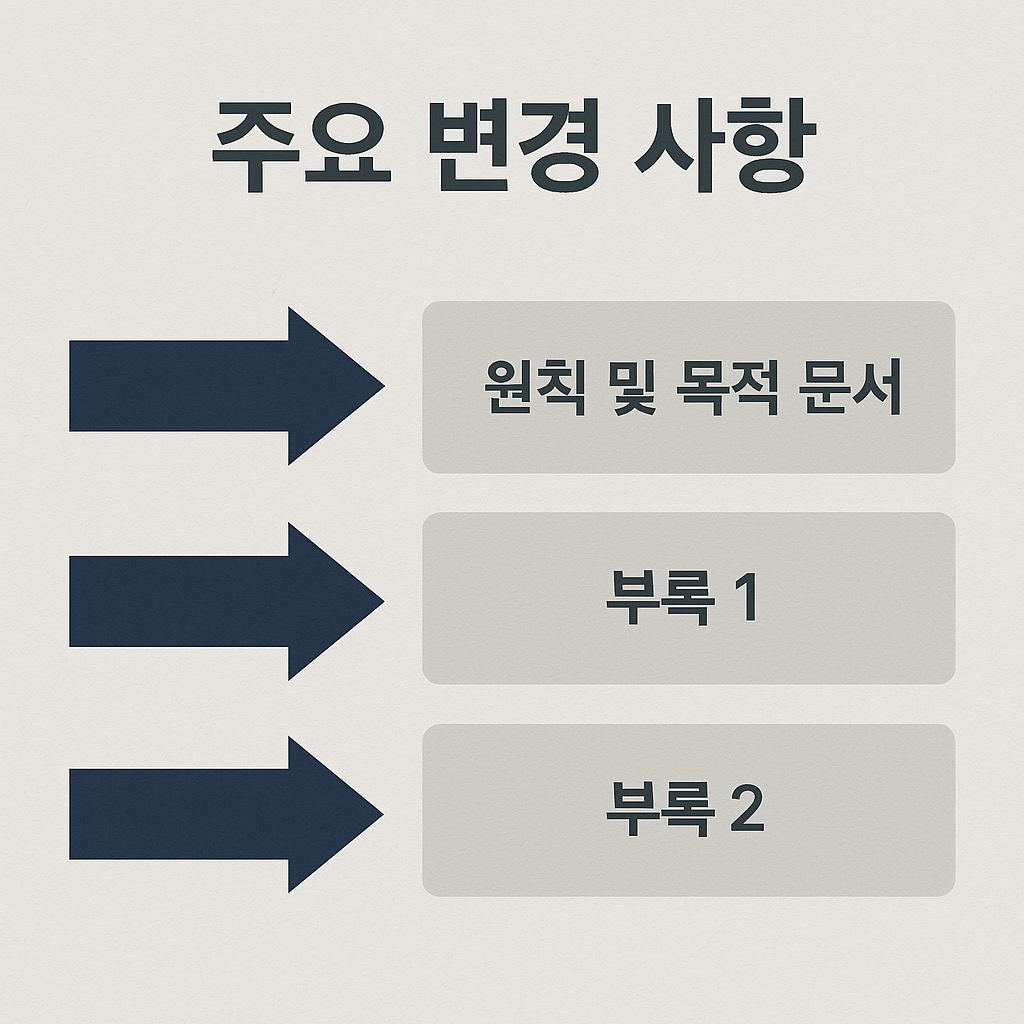
기존 E6(R2)은 하나의 단일 문서였지만, R3에서는 다음과 같이 3개의 문서로 분리되었습니다:
- ① 원칙 및 목적 문서 (Principles and Objectives)
임상시험의 핵심 윤리 원칙과 목표를 제시 - ② 부록 1 (Annex 1): 전통적 중재적 임상시험
현재 일반적으로 수행되는 임상시험에 대한 지침 - ③ 부록 2 (Annex 2): 비전통적 중재적 임상시험
DCT(Decentralized Clinical Trial), RWD( Real World Data)활용, 실용적 시험 등을 다룸
⚠️ 단, Annex 2는 아직 개발 중이며 최종화되지 않았습니다.
✅ 포인트: 다양한 시험 유형에 맞춘 유연한 적용이 가능해졌어요!
2. 🔄 설계와 수행의 유연성 강화
- 위험 기반 및 비례적 접근 (Risk-proportionality)
→ 시험의 위험도에 따라 모니터링·관리 방식 조정 가능 - 혁신 기술 및 설계 도입 장려
→ 분산형 임상시험, 전자동의(eConsent), 디지털 헬스 기술 등
→ 효율성과 접근성은 높이고, 데이터 품질은 그대로!
✅ 포인트: 원격 모니터링, 전자 데이터 활용이 더욱 주류가 됩니다.
반응형
3. 👥 참여자 보호 강화
- 연구 투명성 확대
→ 시험 등록 및 결과 공개 권장 - 동의 절차 개선 권고
→ 간략 요약본, 시각자료 등으로 이해 돕기
✅ 포인트: 참여자의 권리 보호가 한층 강화됩니다.
4. 🗓️ 시행일은 언제?
| 항목 | 날짜 |
| 최종 승인일 | 2025년 1월 6일 |
| 공식 발효일 | 2025년 7월 23일 |
| E6(R2) 종료일 | 2025년 7월 22일 |
💡 지금부터 SOP와 프로세스 점검이 필요합니다.
5. 한국의 대응 현황은?
- 식약처는 공식적으로 E6(R3)에 대한 설명회나 지침 발표를 하지는 않았지만, 국제 기준에 맞춰 국내 규정 개정과 교육을 준비 중일 가능성이 큽니다.
- 예상: 향후 '임상시험 관리기준(GCP)' 개정 또는 설명회 등을 통해 E6(R3) 반영 예정
6. 💬 CRA와 연구자에게 미치는 영향
| 변화 항목 | 실무 영향 |
| 가이드라인 구조 재편 | 시험 유형별 SOP 분리 검토 필요 |
| 위험 기반 접근 | CRA의 리스크 평가 역량 요구 증가 |
| 기술 활용 확대 | eConsent, eSource 등 디지털 툴 숙지 필요 |
| 참여자 보호 강화 | 설명 자료의 다양화, 교육 강화 요구됨 |

✅ 결론: 임상시험, 이제는 더 유연하고, 더 사람 중심으로
ICH E6(R3)는 단순한 개정이 아니라 임상시험의 패러다임 전환이라 볼 수 있습니다.
CRA, 연구자, 스폰서 모두 변화에 적극 대응해야 하며, 변화의 중심에는 참여자 보호와 데이터 신뢰성 확보가 있습니다.
📌 지금이 바로 준비할 타이밍!
새로운 기준에 맞춰 SOP, 교육자료, 내부 프로세스의 점검이 필요할 수 있겠습니다.
SMALL
📂 출처:
💡 유튜브 영상으로 정리된 내용도 함께 살펴보세요!
728x90
반응형
SMALL
'건강한 라이프' 카테고리의 다른 글
| 임상시험에 참여하면 신약을 꼭 투여받는다? 진실은 이렇습니다 (2) | 2025.04.12 |
|---|---|
| 🧪 임상시험, 정말 위험할까? 오해와 진실 한눈에 보기 (0) | 2025.04.10 |
| CRO란? 임상시험 업계 초보 CRA를 위한 쉬운 설명 (0) | 2025.04.08 |
| 임상시험종사자교육(GCP 교육)이란? (0) | 2025.04.06 |
| 📌 CRA, LM과 효과적인 1:1 미팅 준비 및 진행 가이드 (0) | 2025.04.05 |



